ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА ФОСФОРА В СИСТЕМАХ НА ОСНОВЕ СаО
Методом химического равновесия исследована способность к образованию фосфатов систем СаО CaF2 SiO» СаО ВаО CaF2 SiOv СаО CaF2 СаС12 и СаО А12Оъ в интервале температур 1573—1773 К. Коэффициент распределения фосфора между флюсом СаО — CaF2 — Si02 и насыщенным углеродом железом вдоль линии ликвидус СаО увеличивается с уменьшением содержания SiO% Введение 26 % (по массе) ВаО в расплавы СаО — CaF2 —Si02 увеличивает коэффициент распределения фосфора в 10 раз. Исследовано влияние замены CaF2 на СаС12 на способность флюса CaQ^nnJm — CaF2 — СаС12 к образованию фосфатов. Подтверждена более высокая термодинамическая эффективность CaF2 при дефосфорации по сравнению с СаС1т Способность системы СаО — А12Оъ к образованию фосфатов при Т773В настоящее время все увеличивается интерес к методам удаления примесей, например фосфора, из жидкого металла и снижения их содержания до чрезвычайно низкого уровня с целью получения сверхчистых сталей. Для удаления фосфора чаще всего используют флюсы на основе СаО. При традиционных способах выплавки стали флюс СаО — CaF2 — Si02 после обработки обычно насыщен СаО и SCaO'SiO^ Один из авторов изучил термодинамические свойства фосфора в системе СаО CaF2 — Si02 и показал, что добавление Na20 к флюсам существенно увеличивает способность к образованию фосфатов, как показано в работе [1]. В настоящей работе способность системы СаОдоэдц — CaF2 — Si02 к образованию фосфатов измерялась при температуре жидкого металла. Для насыщения флюса СаО использовали монокристалл СаО. Использование Na^ для обработки жидкого металла вызывает немало трудностей изза эрозии огнеупорной кладки, испарения NajO и др. Поэтому в работе изучали влияние добавок ВаО к флюсу СаО — CaF2 — Si02 на коэффициент распределения фосфора между флюсом СаО CaF2 — Si02 и насыщенным углеродом железом.
Исследовали также влияние замены CaF2 на СаС12 на способность флюса СаО дасыш — CaF2 — Si02 к образованию фосфатов.
Флюсы для ЭШП должны обладать высокой рафинирующей способностью по отношению к таким примесям, как сера и фосфор, и высокой электропроводностью. Поэтому измеряли коэффициент распределения фосфора между флюсом СаО А12Оэ И насыщенным углеродом железом.
Методика эксперимента
В работе использован метод химического равновесия. Для получения равновесного состояния 3 г расплава СаО — CaF2 — Si02 — PO^ нагревали с 1 г насыщенного углеродом сплава железо — фосфор в графитовом тигле (внутренний диаметр 8—11 мм, наружный диаметр 14—17 мм, высота 20—30 мм) при 1573 К в среде СО в течение 18—24 ч. Монокристалл СаО весом около 0,1 г находился в контакте с расплавом флюса для обеспечения насыщения СаО. Поскольку состав флюса был выбран таким образом, чтобы он оставался слегка ненасыщенным относительно СаО в соответствии с диаграммой состояния, осаждения избыточного СаО в расплавленных флюсах не происходило. Количество фосфора во флюсах и в железе, насыщенном углеродом, составляло 0,1—0,6% (по массе).
Влияние введения ВаО на коэффициент распределения фосфора изучали при добавлении от 0 до 26 % (по массе) ВаО к флюсу СаО — CaF2 — Si02, насыщенному СаО и ЗСаО • Si02. 2 г флюса СаО — CaF2 — СаС12 — РО^ были приведены в равновесное состояние с 3 г расплавленного сплава серебро—фосфор при 1673 К в условиях насыщения СаО с целью сравнения влияния добавок CaF2 и СаС12 к флюсам на основе СаО. Количество фосфора в флюсе составляло ОД — 0,6 % (по массе), а в серебре — 0,001—0,02% (по массе). 4 г флюса СаО — А12Оэ [количество СаО в флюсе составляло 42 — 55% (по массе)] приводили в равновесное состояние с железом, насыщенным углеродом, при 1773 К в графитовом тигле в среде СО. Содержание фосфора в флюсе и в железе, насыщенном углеродом, составляло соответственно 0—0,1 и 5—11% (по массе).
Содержание фосфора определяли колориметрическим методом в железе, насыщенном углеродом, на основе голубого раствора молибдена, а в серебре — по раствору молибдата ванадия. Содержание СаО и СаС12 определяли.?
титрованием и методом Моора соответственно. Содержание ВаО и Si02 определяли гравиметрическим методом.
Система СаО — CaF2 — Si02
На рис.1 показан коэффициент распределения фосфора между расплавами СаО — CaF2 — Si02 и железом, насыщенным углеродом, при 1573 К, а также парциальном давлении кислорода 2,80 • 10”12 Па. Темные кружочки на графике относятся к результатам, полученным в настоящей работе, а светлые кружочки и квадратики — к данным, опубликованным в работе [1]. Коэффициент распределения фосфора увеличивается с увеличением содержания СаО вплоть до достижения состава двойного насыщения СаО и 3Ca0*Si02. Затем коэффициент распределения фосфора увеличивается с увеличением содержания CaF2 вдоль линии ликвидус СаО. Аналогичное поведение наблюдали и в случае коэффициента распределения серы между флюсом той же системы и насыщенным углеродом железом [2]. Значения способности к образованию фосфатов, определенной по уравнению (2) [3], в соответствии с реакцией (1) также показано на рис.1:
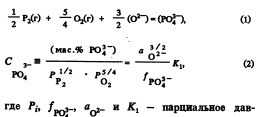
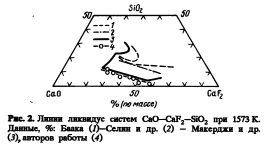
В настоящей работе с помощью монокристалла СаО обеспечивали насыщение флюса СаО, что позволило при данном составе флюса получить линию ликвидус СаО. Линия ликвидус флюса, насыщенного СаО, показана на разрезе тройной диаграммы на рис.2 вместе с данными из работ [7, 8 и 9J. Наши данные ближе к ликвидусу на наиболее часто используемых диаграммах состояния [7], чем недавно полученные данные Селина и др. [8]. Хотя, по видимому, Селин и др. определили ликвидус очень тщательно, причина такого расхождения не очень ясна.
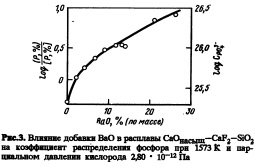
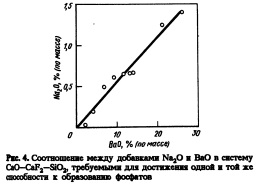
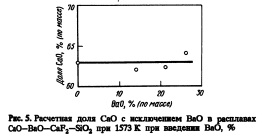
Способность к образованию фосфатов также показана на рис.З. При добавке 26% (по массе) ВаО коэффициент распределения фосфора увеличивается в десять раз. Однако десятикратного увеличения коэффициента распределения фосфора достигали при введении в тот же флюс 2% (по массе) NajO [1]. На рис.4 показано соотношение между добавками NajO и ВаО в систему СаО — CaF2 — Si02, необходимыми для обеспечения одинаковой способности расплава к образованию фосфатов. Введение ВаО менее эффективно с точки зрения дефосфорации, чем введение Na20. Эта тенденция объяснима изменением основности основных оксидов в ряду Ns^O, ВаО и СаО. Влияние содержания ВаО на рассчитанную долю СаО при исключении ВаО в расплавах СаО — ВаО — CaF2 — Si02 показано на рис.5. Отношение СаО, CaF2 и Si02 не зависит от содержания ВаО вплоть до 26% (по массе).
Система СаО — СаР2 — СаС12
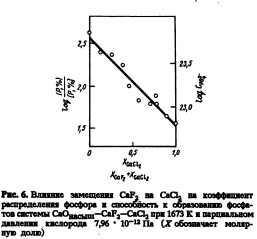
Влияние замещения CaF2 на СаС12 на молярной основе на коэффициент распределения фосфора в системе СаО — CaF2 — СаС12 при 1673 К и парциальном давлении кислорода 7,97 • 1012Па показано на рис.6. Замещение CaF2 на СаС12 уменьшает коэффициент распремость способности к образованию фосфатов от активности СаО [и] в системе СаО А1203 показана деления фосфора. Аналогичное поведение наблюдали в системах СаО — CaFa — Si02> насыщенных СаО и ЗСаО * Si02 [1]. Кроме того, Симеонов и др. [ю] наблюдали аналогичную зависимость для способности системы CaOCaF2 СаС12 к образованию сульфидов. Таким образом, с термодинамической точки зрения, применение CaF2 для дефосфорации горячего металла более эффективно, чем СаС12.
Система СаО А12Оъ
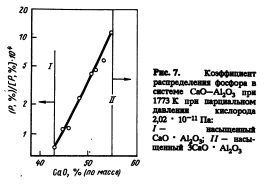
Коэффициент распределения фосфора между флюсом СаО — А12Оэ И железом, насыщенным , углеродом, при 1773 К и парциальном давлении кислорода 2,02 * 10~иПа показано на рис.7. Коэффициент распределения увеличивается с повышением содержания СаО. Зависи
Рис. 7. Коэффициент распределения фосфора в системе
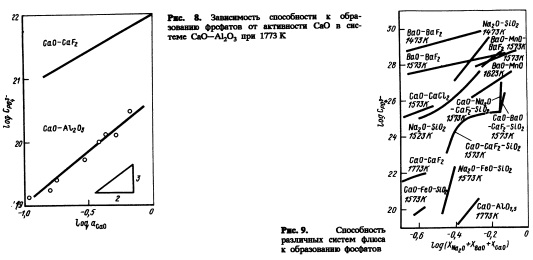
На рис.9 сопоставлены способности к образованию фосфатов флюсов на основе СаО и флюсов других систем [6]. Видно, что введение ВаО или NajO в флюсы на основе СаО существенно влияет на дефосфорацию горячего металла.
В настоящей работе исследованы термодинамические характеристики фосфора в системах флюсов на СаО ВаО CaF2 Si02, — AI2O3.
Как показали авторы в предыдущих работах [13, 14], основные оксиды, т&к же как ВаО или NajO, термодинамически более эффективны по сравнению с СаО для дефосфорации жидкого металла. Однако, как показано в работе, с учетом производственных затрат и обработки флюса после дефосфорации вместо использования ВаО или NajO содержащего флюса желательно вводить небольшие количества ВаО или Na^ в флюсы на основе СаО.
СБОРНИК НАУЧНЫХ ТРУДОВ Черная металлургия России и стран СНГ в XXI веке. Т о м 3, Москва 1994
