ПОЛУЧЕНИЕ ХРОМИРОВАННОЙ ЖЕСТИ ЭЛЕКТРОЛИЗОМ ИЗ БЕЗВРЕДНЫХ ЭЛЕКТРОЛИТОВ. ТЕОРЕТИЧЕСКИЕ И ПРИКЛАДНЫЕ АСПЕКТЫ
В 60х годах в ЦНИИЧМ был разработан новый материал — хромированная лакированная жесть (ХЛЖ), предназначенный для замены дефицитной луженой жести, широко использовавшейся в первую очередь в качестве тароупаковочного материала для консервной и других отраслей промышленности. ХЛЖ представляет собой сталькую полосу с нанесенным на нее тонким (от 0,02 до 0,05 мкм) слоем хрома, дополнительно покрытую> лаком. В настоящее время реализован промышленный способ получения этого материала, основанный на гальваническом покрытии стали 08КП хромом из раствора Cr(VI) и нанесении на полученное хромовое покрытие пищевого лака ЭП527х. Получаемая таким способом ХЛЖ по своей коррозионной стойкости удовлетворяет требованиям, предъявляемым к ней [1, 2]В связи с токсичностью применяемых при промышленном получении ХЛЖ электролитов на основе Cr(VI) уже давно стал актуальным вопрос об их замене на безвредные растворы. Принципиально такая замена может быть осуществлена при использовании соле$ трехвалентного хрома, поскольку основное ограничение их использования в гальванотехнике связано, как известно, с трудностью получения толстых покрытий, которые в случае производства ХЛЖ ке требуются. Кроме того, при использовании Cr(lll) вместо Cr(VI) при электролизе можно было рассчитывать на покрытие стали не только хромом, но и его сплавов с железом. Последнее же представляет интерес по экономическим соображениям, но трудно осуществимо из растворов Fe(ll), содержащих Cr(VI), и принципиально возможно из растворов Fe(ll) + Cr(lll).
Выяснения возможности использования электролитов на основе Cr(lll) при получении ХЛЖ, а также определение оптимальных условий проведения электролиза в этих растворах и явилось целью настоящей работы.
Решение поставленной задачи требовало, с одной стороны, систематических исследований кинетических закономерностей электроосаждения хрома и сплавов FeCr, а с другой стороны — изучения влияния условий электролиза на механические, адгезионные и коррозионные свойства ХЛЖ, получаемой электролизом растворов на основе Сг(111).
Анализ литературы [35] показал, что при хромировании из растворов Cr(lll) и Cr(lll) + Fe(ll) целесообразно в качестве фоновых добавок к электролиту использовать мочевину и сульфат аммония. Специально проведенное исследование показало, что наилучшие результаты можно получить при их 2 М концентрациях в растворе и при pH = 23: ‘ Парциальная поляризационная кривая электроосаждения хрома, полученная с применением прямых аналитических методов [6] в растворе такого фонового состава с концентрацией Cr2(S04)3, равной 0,48 М и pH = 2, приведена на рисунке (кривая 1). Там же для сравнения приведена суммарная поляризационная кривая (кривая 4\ измеренная по току. Анализ этих кривых приводит к выводу, что процесс электроосаждения хрома в указанных условиях будет проходить с максимальной скоростью и максимальным выходом по току (ВТ) в области потенциалов начала участка предельного тока на кривой 1.
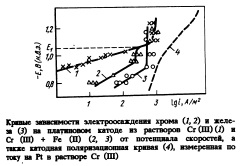
Понятно, что выбор оптимальных (в отношении получения покрытий с максимальными скоростями и ВТ) условий электролиза требует, в первую очередь, определения зависимости скоростей электроосаждения хрома от концентрации соли Cr(lll) и pH раствора (т.е. выяснения значений порядка реакции разряда ионов Сг3+ по собственным ионам и по ионам Н+). Было показано, что в исследованной области значений соли Cr(lll) (ССг) (0,05М 0,48М) и pH (0,43,5) скорость реакции электроосаждения хрома (/<>) не зависит от pH электролита и закономерно возрастает с увеличением содержания сульфата хрома (dl\giCr/ d\gCCr = 1; <Я&сг/ = °)
Следует отметить, что при увеличении pH электролита до значения 3,8 [близкого к значению pH гидратообразования Сг(111)] скорость электроосаждения хрома заметно снижается. Однако снижение скорости в этом случае вероятнее всего связано не с изменением кинетических характеристик, а со вторичными эффектами, скорее всего — с заполнением поверхности электрода основными соединениями хрома и изолированием ими части поверхности. Это подтверждается как внешним видом электрода (на его поверхности пошляется матовый, серозеленый, легко снимающийся механически налет), так и характером изменения скорости электроосаждения во времени.
Измеренные по току суммарные поляризационные кривые, полученные для различных pH электролита и концентраций сульфата хрома /111), показали, что скорость суммарного процесса (разряда Сг+ и выделения ч Н2) мало зависит от pH и ССг: при возрастании концентраций ионов Н+ и Сг* она незначительно увеличивается.
Учитывая приведенные выше результаты, можно ожидать, что получение хромовых покрытий с максимальными скоростью и выходом по току возможно при значениях pH электролита, равных 23, концентрации Cr2(S04)3, равной 0,48 М (дальнейшее увеличение концентрации соли Cr(lll) затруднительно по соображениям ее растворимого) и потенциала электоосаждения (1,05)—(1,5) В (н.в.э.). В гальваностатических условиях этой области потенциалов соответствуют (при указанных выше значениях pH и концентрации соли Cr(lll)) плотности катодного тока (DK)f равные (36) • 103А/м2. Экспериментальная проверка такого предположения подтвердила его справедливость и позволила сделать вывод о том, что указанные условия являются оптимальными для осуществления хромирования из раствора Cr(lll). В этих условиях можно осуществить получение хромового покрытия с выходом по току более 20%. Причем для получения покрытия толщиной, необходимой для ХЛЖ, время электролиза составляет 12,5 с (вместо 25 с, необходимых для получения хромового слоя достаточной толщины по применимой в настоящее время технологии). В указанных условиях хромовые покрытия имеют наименьшую пористость и обладают наилучшим качеством (по визуальной оценке).
При переходе от растворов, содержащих только сульфат хрома (111) (на фоне выбранных в работе добавок), к смешанным растворам, содержащим наряду с Cr2(S04)3 также FeS04, характер зависимости скорости осаждения хрома от потенциала заметно меняется. Это иллюстрируется данными, приведенными на рисунке. Здесь кроме кривых осаждения хрома из чистого (кривая 1) и смешанного (кривая 2) электролитов (концентрация Cr2(S04)3 составляет 0,48М) приведена парциальная кривая соосаждающегося с хромом железа (кривая 3) для концентрации FeS04, равной 0, 1 М). Как видно, при относительно отрицательных потенциалах скорости осаждения хрома из индивидуальных и смешанных электролитов совпадают. При более положительных потенциалах (Е > Ег) скорость осаждения хрома при переходе от индивидуального электролита к смешанному заметно возрастает, что свидетельствует об ускоряющем действии на процесс осаждения хрома протекающего одновременно с ним процесса осаждения железа. Одновременно с этим происходит изменение тафелевского наклона поляризационной кривой и появление на ней участка предельного тока, значение которого значительно ниже величины предельного диффузионного тока по хрому.
Сравнение формы участка поляризационной кривой электроосаждения хрома при Е>ЕХ с формой кривой осаждения железа при этих Е из того же электролита показывает, что в рассматриваемой области потенциалов обе кривые параллельны. Близкое по величине к порогу перколящш для решетки железа содержание хрома в осадке 1012 % (судя по соотношению скоростей осаждения железа и хрома) свидетельствует о принципиальной возможности захвата хромовых частиц. Справедливость такого предположения подтверждается тем, что указанное соотношение железа и хрома в гальваническом осадке (полученном при Е, при которых наблюдается ускоряющий эффект) сохраняется таким же и при других концентрациях соли Fe(ll) в электролите.
В работе была предпринята попытка решения вопроса о природе захватываемых хромовых частиц с помощью анализа гальванического осадка методом Ожеэлектронной спектроскопии. С применением этого метода было показано, что осадки FeCr, полученные в области Е, при которых наблюдается явление ускорения электроосаждения хрома, имеют относительно высокое содержание кислорода. Это позволило предположить, что входящие в соствав гальванического осадка хромовые частицы представляют собой продукты неполного восстановления Сг+(СгО или CKOHj)). В то же время было показано, что при потенциалах, при которых ускоряющее действие железа на процесс электроосаждения хрома отсутствует, образуется гальваническое покрытие, практически не содержащее оксидов, и, следовательно, осадок, получаемый при этих Е, представляет собой сплав FeCr.
Таким образом, можно заключить, что в условиях, когда образуются собственно сплавы FeCr, скорости осаждения хрома при переходе от осаждения индивидуального металла к осаждению сплава не изменяются.
Для того чтобы иметь возможность прогнозировать условия получения сплавов заданного состава, необходимо было исследовать и закономерности электроосаждения железа из смешанных электролитов. С этой целью были изучены зависимости скорости осаждения железа от pH электролита и концентраций в нем ионов Fe+ и Сг+. Установлено, что скорость осаждения железа (ipе) не зависит от концентрации соли хрома в растворе (при Q> до 0, 48 М), но возрастает пропорционально увеличению концентрации ионов Fе2+(Сре) и обратно пропорционально концентрации ионов Н+ в электролите (dlgipe/dhgCpe = 1; dLgipJ dpH = l).
Знание этих закономерностей, а также зависимости скорости осаждения железа от потенциала (см. рисунок, кривая 3) позволило определить условия получения гальванических осадков с различным соотношением в них железа и хрома (от 25 до 60 % Сг; 0,48 М растворы Cr2(S04)3 с добавками FeS04) при концентрациях 0,4 и 0,1 М соответственно; pH = 2; область потенциалов (1,05) — (1,15) В или плотность тока (47) • 103А/м2. Эти же условия отвечают условиям получения железохромовых покрытий с максимальными скоростью и ВТ (ВТ >30%, время электролиза для получения покрытий толщиной 0,02 0, 05 мкм составляет 0,51,5 с). Как и в
случае хромовых покрытий, гальванические покрытия из сплавов FeCr, осаждающиеся в указанных условиях, отличаются наилучшим (оцененным по внешнему виду образцов) качеством: являются наиболее равномерными.
Таким образом, на основании изучения кинетических закономерностей электроосаждения железа и хрома из электролитов на основе Сг(111) и Cr(lll) + Fe(ll) в работе определены условия получения покрытий хорошего качества с максимальными скоростью электроосаждения и ВТ.
Однако, как указывалось в начале работы, специфика требований, предъявляемых к хромированной жести, делает необходимой детальное исследование механических, адгезионных и коррозионных свойств ХЛЖ с покрытиями, полученными предлагаемыми в работе методами. Для исследования механических и адгезионных свойств в работе были применены методы испытаний ХЛЖ, рекомендуемые ТУ.
Механические испытания (методами удара и Эриксена) адгезионных свойств поверхности жести по отношению к лаку были проведены для всех исследованных условий хромирования и получения покрытий из сплавов FeCr. Их результаты во всех случаях, независимо от толыцины (от 0,01 до 0,20 мкм) гальванического покрытия, были положительными: лаковая пленка на всех образцах сохраняла целостность и при ударе, и при выдавливании лунки.
Различия в адгезионных свойствах удалось выявить только в значительно более жестких условиях испытаний: кипячением деформированных образцов в 3 %ном растворе NaCl в течение 2 ч (в результате эти* испытаний пленка лака не должна отслаиваться от поверхности металла или разрушаться). Положительные результаты испытаний ХЛЖ с хромовыми покрытиями были получены только для образцов, хромированных в указанных ранее оптимальных условиях. Из образцов ХЛЖ с покрытиями из сплавов Fe — Сг различного состава выдерживали испытания только образцы, покрытие которых представляло собой сплав Fe 60% Сг.
Последнее несколько сокращает интервал условий электролиза в смешанных электролитах, определенный нами как оптимальный: с учетом результатов испытания адгезионных свойств гальванических покрытий из сплавов, для ХЛЖ следует рекомендовать условия электролиза: раствор 0,48 * М Cr/SO^ + 0,1 М FeS04; pH = 2; DK = (56)" НРА/м2.
Учитывая жесткие медицинские нормы на скорость перехода хрома из ХЛЖ в пищевые среды, коррозионную стойкость этого материала определяли по скоростям перехода ионов Fe2+ и Сг3+ в модельные пищевые среды: 1) 3 %ный раствор NaCl; 2) 1 %ный раствор лимонной кислоты; 3) 0,5 % СН3СООН + 2 % NaCL. .
Исследовали влияние плотности катодного тока при осаждении хромового покрытия и покрытия из сплава FeCr и толщины покрытия. Установлено, что независимо от этих характеристик скорости перехода железа в нейтральную среду (3 % NaCl) составляют (1,16,4) • 105 г/м2ч, а в наиболее агрес
сивную кислую среду (0,5 % СН3СООН + 2 % NaCl) эта скорость равна (4,06,5) • 10“4 г/м2ч. Что же касается скорости перехода в эту среду хрома, то в исследованных условиях она оказалась ниже предела чувствительности применяемого нами аналитического метода и составляла величину меньше, чем 1,4 • J.07 г/м2 • ч.
Сравнение этих результатов со скоростями перехода железа и хрома из ХЛЖ, получаемой в промышленности с применением растворов Cr(VI), показывает, что по коррозионной стойкости материала, получаемой по разработанному в настоящей работе способу, не уступает промышленному.
На основе проведенных научных исследований рекомендован (и с положительным результатом прошел апробацию) новый способ получения хромированной лакированной жести, применяемой в качестве тароупаковочного материала для консервной, пищевой и химической промышленности. Метод основан на гальваническом осаждении на стали перед ее лакированием хрома или сплава FeCr и по сравнению с существующим способом является более выгодным как экономически (изза большей скорости осаждения и более высокого выхода по току металлического покрытия), так и экологически [в связи с использованием в техонологии вместо токсичных растворов Cr(Vl) безвредных электролитов на основе Сг(111)].
СБОРНИК НАУЧНЫХ ТРУДОВ Черная металлургия России и стран СНГ в XXI веке. Т о м 5, Москва 1994
