ОЧИСТКА ЖИДКОМЕТАЛЛИЧЕСКИХ ТЕПЛОНОСИТЕЛЕЙ
Состояние примесей. При использовании жидких металлов в высокотемпературных тепловых трубах существенное значение имеют газовые и металлические примеси. Легкодиссоциирующие соединения типа гидридов щелочных металлов могут при нагреве теплоносителя разлагаться и выделять большое количество не- конденсирующегося газа. При нагреве также выделяются в газовую фазу примеси газов, находившиеся в растворе. Неконденсирующиеся газы могут существенно влиять на работу тепловой тру- ¦бы: увеличивать ее неизотермичность, блокировать часть рабочей поверхности зоны конденсации. Выделяясь в зазоре между капиллярной сеткой и стенкой, газы могут приводить к осушению составных фитилей и т. д.
Соединения типа окислов могут скапливаться в порах в зоне испарения и закупоривать капиллярные отверстия фитиля. Примеси также существенно влияют на коррозионную стойкость конструкционных материалов в жидких металлах.
Количество и формы существования примесей в зависимости от конкретных условий изменяются в самых широких пределах. Они могут находиться в жидком металле как в виде молекулярного раствора, так и в виде твердой фазы, в свободном виде и в виде простых, сложных и комплексных соединений, в виде интерметаллидов и т. п.
Форма существования примеси существенно влияет на свойства жидкого металла, определяет применение того или другого метода очистки и контроля. Так, перераспределение неизменного количества кислорода между металлическими примесями в растворе, например между кальцием, барием, литием и т. п. в растворе лития, при изменении температуры приводит к изменению сигнала прибора, контролирующего содержание кислорода в литии по изменению электросопротивления. Эффективность дистилляционного метода очистки выше, если примесь находится в виде термически устойчивых соединений. Особое значение форма существования примеси в остатке после дистилляции имеет для дистилляционного метода контроля чистоты жидких металлов. В зависимости от формы примеси выбирают и метод количественного определения примеси в остатке после дистилляции.
Знание формы существования примесей в жидких металлах необходимо для понимания процессов очистки и контроля чистоты, для понимания поведения примесей при изменении температурных и концентрационных условий, для анализа процессов газо- выделения из жидких металлов и процессов коррозии. Известные и применяемые в настоящее время методы физико-химического анализа жидких металлов, как правило, не позволяют определить, в форме какого соединения находится тот или другой элемент примеси. Необходимо дальнейшее развитие методик определения форм существования примесей посредством физических, химических, рентгеноструктурных и других анализов. Предварительное суждение о состоянии примесей можно составить, используя расчетный аппарат химической термодинамики. Химико-термодинамические расчеты могут быть выполнены, если известны величины, характеризующие термодинамическую стабильность соединений, которые вступают во взаимодействие друг с другом в растворе жидкого металла. Такими величинами являются изменения изобарно-изотермических потенциалов реакций взаимодействия или реакций образования примесей AZ°. Так как для точного расчета необходимы эмпирические константы (например, активность а), отсутствующие в большинстве случаев, то расчеты могут быть выполнены лишь при некоторых упрощающих предпосылках. Однако, даже несмотря на упрощения, с помощью термодинамических расчетов можно получить представления о характере системы жидкий металл — примеси, о взаимосвязях между отдельными элементами и об основных закономерностях, которым эти взаимосвязи подчиняются.
При расчетах состояния примесей учитываются существование параллельных (одновременно протекающих) реакций взаимодействия одной примеси, например водорода, с другими (кислородом, натрием, литием, калием, магнием, железом и т. п.), учитываются реакции термической диссоциации продуктов взаимодействия и т. д. В жидком металле могут существовать одновременно многие формы одной и той же примеси. Количественное соотношение этих форм определяется равновесным состоянием одновременно протекающих реакций взаимодействия между ними и характеризуется термодинамической константой равновесия. Для обобщенной реакции взаимодействия теплоносителя (жидкого металла) Мет с металлическими примесями Меп

Для определения количественного равновесного соотношения между различными формами существования данного примесного элемента в растворе жидкого металла проводится совместное решение системы уравнений типа (3.1) для всех параллельно протекающих реакций взаимодействия.
В результате термодинамических расчетов и экспериментальных исследований форм существования примесей установлены основные формы существования неметаллических примесей в щелочных металлах [1].
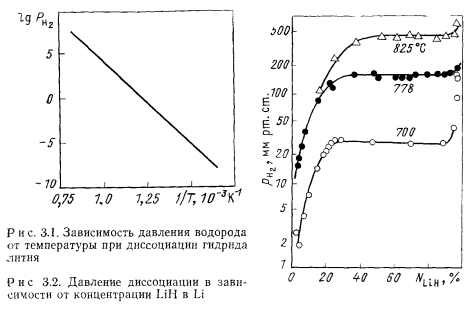
Примеси в расплавленном литии. Кислород при избытке лития существует лишь в форме Li20 и в виде окислов некоторых металлических примесей. При изменении температуры и общей концентрации кислорода происходит перераспределение кислорода между Li20 и BeO, MgO и СаО. Однако от окисей бериллия, магния, кальция литий, натрий и другие щелочные металлы можно очистить вакуумной дистилляцией. Азот в литии находится в виде нитрида, углерод в виде карбида Li2C2. Могут быть также нитриды бериллия, титана, кальция и циркония и карбиды титана и циркония. Наиболее вероятной формой существования водорода в литии является гидрид лития LiH. Гидрид лития легко диссоциирует. Давление диссоциации гидрида лития в зависимости от температуры дано на рис. 3.1. При данной температуре равновесно существуют раствор гидрида лития в литии и существенное количество свободного водорода над поверхностью расплавленного лития. Парциальное давление водорода зависит от температуры системы и концентрации гидрида лития в литии. На рис. 3.2 приведено давление свободного водорода над поверхностью лития в зависимости от температуры и концентрации гидрида лития в литии [2]. По мере увеличения концентрации гидрида в растворе, как видно из рисунка, растет давление свободного водорода при данной температуре. При достижении концентрации насыщения дальнейшее увеличение количества гидрида приводит к увеличению нерастворенной твердой фазы гидрида. При этом концентрация растворенного гидрида постоянна и равна концентрации насыщения. Давление водорода тоже постоянно и равно давлению диссоциации гидрида лития при данной температуре. В области очень высоких концентраций гидрида (близких к 100%, т. е. в области растворов жидкого металла в гидриде) давление свободного водорода может существенно превышать давление диссоциации чистого гидрида.
Зависимость давления водорода над ненасыщенным щелочным металлом и, в частности, над ненасыщенным литием от концентрации водорода в литии близка к параболической. Аналогичное равновесие между газом и раствором в металле существует и в системе литий—азот, литий — углекислый газ и т. п. Однако равновесное давление азота и тем более кислорода при той же температуре значительно ниже давления водорода.
Следует отметить, что соединения водорода с металлическими примесями в литии маловероятны, так как количество металлических примесей существенно более активных к водороду, чем сам литий, пренебрежимо мало.
Примеси в расплавленном натрии и калии. Натрий, в отличие от лития, имеет менее прочную молекулу окиси. Поэтому картина распределения кислорода значительно сложнее, чем лития. Так, кислород в натрии может находиться в виде окиси натрия и окислов металлических примесей натрия. Кроме того, кислород может быть в виде гидроокиси NaOH и карбоната Na2C03. Возможно присутствие в натрии ацетилидов NaCH2 и метанидов CH3Na натрия. Однако последние соединения термически непрочны: так, ацетилид разлагается при температуре 210° С. Азот в натрии существует в виде молекулярного раствора и в виде нитридов металлических примесей. Он также может образовывать сложные комплексы с углеродом и с кислородом, например соединения типа CN.
Водород в натрии существует в основном в виде гидрида NaH и при наличии кислорода, не связанного в прочные окислы, в виде NaOH.
В калии имеются те же примеси, что и в натрии. Однако в отличие от натрия в калии более вероятны соединения с кислородом не в виде окиси, а в виде карбоната и гидроокиси. Причем карбонат—наиболее прочное соединение.
Примеси в цезии. В цезии кислород присутствует не только в окисной форме, но и в гидроокисной CsOH. При температуре цезия ниже 500° С в основном будет существовать гидроокись, а избыточные над гидроокисью доли кислорода или водорода буДут образовывать окись цезия или его гидрид. Давление водорода над диссоциирующими соединениями цезия при 300° С составляет над гидридом CsH 5-104 Па, а над CsOH 1 -10~16 Па.
Этот пример с давлением свободного водорода показывает, насколько важна для дегазации металлов и для определения количества неконденсирующихся газов в парах металлов форма примеси в металле. Так, водород в цезии легко диссоциирует в виде гидрида и практически не выделяется в присутствии кислорода. Таким образом, кислород можно считать хорошим геттером при очистке цезия от водорода (например, в процессе дистилляции) .
Очистка жидкометаллических теплоносителей. Химическая очистка. Химическая очистка жидких металлов основана на восстановлении примесей, растворенных в теплоносителе. В результате этого процесса образуется соединение очищаемой примеси с восстановителем (геттером). Соединение с геттером должно быть менее растворимым в теплоносителе, чем исходное соединение примеси с теплоносителем. Применяемые для химической очистки геттеры могут быть использованы, как правило, для очистки теплоносителя от определенных примесей.
Предварительный подбор геттеров может быть проведен на основе химико-термодинамических расчетов реакций геттера с примесью или группой примесей в теплоносителе по той же методике, что и расчет состояния примеси в теплоносителе.
Из всего многообразия принципиально пригодных геттеров наиболее приемлемыми на практике следует считать для очистки от кислорода лития — кальций, иттрий; для цезия, натрия, калия и их сплавов — цирконий и титан. Для очистки лития, цезия, натрия и калия от азота и углерода также весьма эффективными являются цирконий и титан. Таким образом, с помощью набора,, по существу, из трех доступных и дешевых геттеров (титана,, циркония, кальция) можно очистить литий, цезий, натрий и калий от основных примесей (кислорода, азота, углерода). Каждый из этих геттеров теоретически обладает способностью к достаточно глубокой очистке. Так, остаточная концентрация кислорода в условиях термодинамического равновесия при очистке натрия и калия по весу во много раз меньше 10-6% для таких геттеров, как титан и цирконий. При экспериментальном изучении этих геттеров нами было установлено, что литий очищается от кислорода с помощью кальция до концентраций (по массе), меньших 4%.
При очистке сплава натрия с калием при помощи циркониевого геттера установлена зависимость поглощенного цирконием кислорода от времени при различных температурах (мг/см2):
Зависимость получена для температур 550—650° С, времени более 4,4 ч и толщины циркониевой фольги 0,2—0,25 мм. Анализ собственных и литературных данных показал, что скорость процесса очистки определяется скоростью диффузии кислорода в циркониевой фольге. Скорость омывания геттера теплоносителем и концентрация кислорода в нем практически не сказываются на скорости очистки. Исключения составляют режимы, когда при слишком малой скорости теплоносителя или очень малой концентрации кислорода скорость подвода кислорода к геттеру меньше его поглощающей способности.
Растворимость циркония в жидком металле пренебрежимо мала. Образующаяся на поверхности циркония пленка двуокиси прочно сцеплена с основой. Опасность ее отцепления и потери практически отсутствует при поглощении кислорода на единицу поверхности циркония меньше 2 мг/см2. Это установлено путем металлографических исследований и измерений механических свойств циркониевой фольги толщиной 0,2 мм. Титан образует на поверхности хрупкую пленку. Это, с одной стороны, увеличивает скорость очистки, так как в реакцию постоянно вступают свежие, не покрытые пленкой, участки поверхности геттера. Но, с другой стороны, нужно принимать меры по улавливанию окиси титана в жидком металле. Свойствами, аналогичными свойствам самого титана, обладают и его 25-, 50- и 75%-ные сплавы с цирконием.
Более сложен подбор геттеров и очистка от водорода. Особенность водородных соединений с геттерами — их относительная непрочность. Так, очистка лития от водорода путем связывания водорода в химическое соединение с геттером практически невозможна. Однако можно существенно снизить концентрацию гидридов лития в литии, предварительно поместив в него торий, лантан или, наконец, кальций и затем провести дистилляцию, дистилляцию с дефлегмацией или ректификацию. Несколько более прочные гидриды геттеров будут концентрироваться после дистилляции лития.
Для химической очистки натрия, калия, цезия от водорода можно применять литий в качестве растворимого геттера. Преимущество растворимых геттеров перед нерастворимыми состоит в том, что очистка протекает с высокой скоростью при значительно меньшей температуре. В этом случае отсутствует самый медленный этап процесса очистки — диффузия примеси в материал твердого геттера.
Однако у растворимых геттеров есть недостаток, связанный с необходимостью сбора соединения примеси с геттером в специальном устройстве, например в холодной кристаллизационной ловушке или в кубовом остатке после дистилляции.
Растворимость лития в натрии и калии неизвестна. Однако прямые опыты показывают, что при 350° С в сплаве Na—К может быть растворено по массе не менее 0,1% лития.
Реакция взаимодействия лития с водородом в сплаве Na—К при 350° С завершается быстро, менее чем за 15 мин.
Еще более эффективно, чем литий, можно использовать растворимый геттер —¦ кальций. Ввиду своего высокого химического сродства к примесям и литий, и кальций способны восстанавливать в остальных щелочных металлах все вредные примеси.
Дистилляционный метод очистки жидких металлов. Дистилляция, как метод очистки металлов от металлических и неметаллических примесей, получила широкое распространение. Она позволяет получать металлы рекордно высокой чистоты. Это метод со сравнительно высокой производительностью и высокой эффективностью отделения основного металла от примесей.
Дистилляционный метод очистки металлов в вакууме основан на различии упругости паров и скоростей испарения, конденсации основного металла и содержащихся в нем примесей. В результате этого содержание примесей в конденсате отличается от содержания их в исходном металле. Процесс дистилляции включает в себя несколько последовательно протекающих стадий: прогрев расплава до температуры испарения, испарение со скоростью, зависящей от параметров испарения, конденсация паров на поверхности конденсатора при заданной температуре. Процесс дистилляции неравновесен. Жидкость в испарителе должна иметь несколько большую температуру, чем температура конденсата, для того, чтобы избыточное давление пара уравновешивало потери давления при движении пара к поверхности конденсации. Учитывая, что дистилляция, как правило, происходит при низком давлении, следует учитывать термическое сопротивление фазового перехода и связанный с этим перепад температуры [3]. При низких давлениях дистилляции гидростатическое давление столба жидкого металла в испарительном сосуде может существенно превышать давление пара металла у поверхности испарения. В области низких давлений температура насыщения сильно зависит от давления. Поэтому температура насыщения у дна сосуда может на сотни градусов превышать температуру насыщения у поверхности жидкости вследствие гидростатического давления. Для возникновения кипения и образования пузырьков пара у обогреваемого дна сосуда нужен соответствующий перегрев. При низких давлениях необходимый для вскипания перегрев может составлять сотни градусов. Такой перегрев в жидком металле обычна невозможен ввиду высокой теплопроводности металлов. Поэтому дистилляция происходит за счет испарения металлов с поверхности без кипения. Как правило, при дистилляции над поверхностью испарения имеется достаточно высокое давление газов и имеет место вязкостное течение пара. В этом случае действительная скорость испарения уменьшается. Большое влияние на скорость дистилляции оказывают состояние и чистота поверхности испарения. Так, присутствие на поверхности пленки нелетучих примесей может существенно снизить коэффициент испарения, уменьшить скорость и даже вообще практически прекратить испарение. Летучие пленки окислов могут увеличить скорость испарения металлов в присутствии остаточного давления кислорода.
Остаточные неконденсирующиеся газы могут сильно понизить (при большом содержании газов практически до нуля) скорость дистилляции вследствие существенного диффузионного сопротивления в процессе конденсации.
Разделение примесей в процессе дистилляции возможно, если парциальные давления очищаемого металла и примесей, содержащихся в них, существенно различаются, т. е. если степень разделения компонентов Ру1Ргфу. В процессе дистилляции происходит постоянное изменение составов пара и остатка. Так, первые порции пара наиболее обогащены легколетучим компонентом. Последняя капля жидкости имеет наименьшее содержание легколетучей примеси. В связи с этим нельзя допускать полного испарения остатка. В испарителе должна оставаться значительная часть жидкости.
Вторым этапом процесса дистилляции, регулирующим степень разделения металлов, является процесс конденсации. Большое влияние на степень разделения компонентов пара при конденсации оказывает температура конденсации. С уменьшением температуры конденсации уменьшается парциальное давление легколетучего компонента над конденсатом. Например, повышение температуры конденсации может привести к лучшей очистке от легколетучей примеси. Чрезмерное повышение интенсивности конденсации, т. е. удельного потока при конденсации, может привести к ухудшению разделения, в частности, из-за того, что более летучие компоненты могут оказаться под слоем менее летучих, не успев испариться.
Описанный выше процесс дистилляции достаточно широко распространен и применяется для очистки различных металлов. Однако с помощью такого простого процесса невозможно получить дистиллят с большим содержанием, например, легкокипящего компонента, чем в равновесном исходному раствору паре в начале процесса дистилляции.
Более полное разделение можно получить дистилляцией с дефлегмацией. Пар, выходящий из испарителя, имеет концентрацию легколетучего компонента, равновесную раствору в испарителе. В процессе дефлегмации осуществляется частичная конденсация этого пара в дефлегматоре до температуры дефлегматора, более высокой, чем температура конденсатора. При этом из пара конденсируются в первую очередь труднолетучие компоненты. Легколетучие составляющие конденсироваться не могут, так как температура в дефлегматоре достаточно высока. Оставшийся пар, обогащенный таким образом легколетучим компонентом, поступает в конденсатор и там полностью конденсируется.
Наибольшая эффективность разделения (очистки) достигается в ректификационных установках, в которых происходит ряд последовательных процессов дефлегмации и обогащения пара легколетучим компонентом. Однако, несмотря на высокую эффективность разделения, ректификационные установки для очистки жидких металлов не применялись.
Параллельно с испарением металлов в вакууме происходит их дегазация в первую очередь вследствие уменьшения растворимости газов при понижении давления. Кроме того, при нагреве происходит термическая диссоциация соединений примесь — металл. Эффективность дегазации в значительной степени зависит от взаимодействия откачиваемых газов с конденсатом. Для предотвращения загрязнения конденсата выделяющимися газами их можно связать в выпарном устройстве в труднолетучие (недиссоциирующие) соединения. Применение в выпарном устройстве геттеров, образующих с газовыми примесями прочные нелетучие •соединения, позволяет лучше очищать металлы от примесей.
Близок к дистилляции процесс обезгаживания металлов. Вакуумной откачкой при невысокой температуре можно в основном удалить газы, растворенные в металле и выделяемые вследствие диссоциации непрочных примесей. Практически методом вакуумной откачки из щелочных металлов удаляют водород и иногда азот. Так, посредством вакуумной откачки при температуре 350° С авторам удалось уменьшить содержание водорода в натрии по массе от Ю1 до 10~4%.
Наиболее изучена дистилляция лития. Экспериментальные данные показывают, что дистилляция позволяет лучше очищать литий от металлических примесей (кроме стронция) и хуже — от газовых. Основная причина плохой очистки от газовых примесей — загрязнение конденсата кислородом и азотом вследствие недостаточной герметичности установок, а также наличия в парах достаточного количества газов. Дистилляцию чаще проводят при вакууме 13,3—0,133 Па и температуре для лития 650—750° С, для натрия и калия около 450° С.
Отстаивание. Опыт показывает, что отстаивание — эффективное средство освобождения расплавленного металла от основной массы взвешенных примесей. Обычно металл отстаивается в баках, служащих для загрузки в дистилляционную установку или непосредственно в рабочую установку. Несмотря на все меры предосторожности, металлы, загружаемые в плавильные баки в виде кусков, сильно загрязняются. Содержание кислорода в щелочном металле при этом может достигать 0,2%. При температуре, близкой к температуре плавления, основная часть примесей находится в виде взвешенной в металле твердой примесной фазы и вследствие различия в удельном весе эффективно отстаивается. Время отстаивания в баке высотой 500 мм составляет для щелочных металлов 4—8 ч (если приняты меры против конвективного перемешивания). После отстаивания металл сливается в другую емкость через трубу, срез которой помещается в отстойнике на достаточном расстоянии от дна, чтобы вместе с потоком металла не увлекались частицы отстоявшейся примеси.
Содержание кислорода в металле после отстаивания близко к концентрации насыщения при температуре отстаивания.
Фильтрование. Фильтрование может быть использовано наряду с отстаиванием для отделения основной части нерастворенных примесей. Для фильтрования расплавленных металлов обычно применяют фильтры, представляющие собой пористые перегородки из спеченных порошков никеля, нихрома и других металлов и сплавов с размерами пор 5—10 мкм и из мелкоячейных нержавеющих сеток с размерами отверстий 10—50 мкм, собранных в пакеты из 3—10 слоев. Содержание примесей в отфильтрованном металле несколько выше концентрации насыщения при температуре фильтрования. Перед фильтрованием жидкий металл обычно выдерживают некоторое время (4—24 ч) в плавильном баке при низкой температуре для установления равновесного состояния и выкристаллизации примесей из раствора. Гидродинамика жидких металлов не отличается от гидродинамики воды и других обычных жидкостей. Поэтому процесс фильтрования металлов может быть рассчитан так же, как и для прочих жидкостей, по общеизвестным формулам. Например, скорость движения натрия через сетчатый фильтр с размерами пор 10 мкм при перепаде давления 1 кгс/см2 составляет около 5000 кг/(м2-ч).
Очистка жидких металлов кристаллизацией в холодных ловушках. Установка для заполнения тепловых труб жидкометаллическим теплоносителем может быть с принудительной циркуляцией теплоносителя по контуру. Это удобно для очистки теплоносителя и для заполнения тепловых труб по методу заполнения «напроток» (см. разд. 3.2). Очистка жидких металлов в циркуляционных стендах с принудительной циркуляцией, как правило, проводится с помощью холодных ловушек, работающих непрерывно и установленных на основном контуре или байпасной линии. В холодной ловушке жидкий металл охлаждается, раствор примеси в жидком металле становится пересыщенным и кристаллизующаяся из раствора твердая фаза примеси удерживается в холодной ловушке. Жидкий металл выходит из ловушки очищенным от примесей.
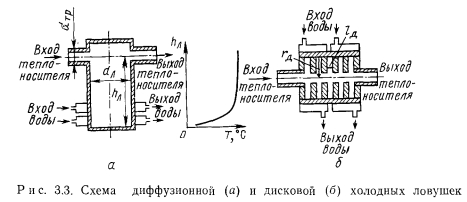
Перспективным типом ловушек являются диффузионные холодные ловушки или их модификация — дисковые ловушки (рис. 3.3). Основные положения, с помощью которых можно выбрать размеры и режимы работы диффузионных ловушек, изложены в работе [1] и сводятся к следующему.
1. Объем ловушки выбирается исходя из предполагаемого поступления примесей в течение всего ресурса работы установки. Следует считать, что примесь заполняет 10—20% объема ловушки. Если нельзя установить количество примесей, поступающих в ловушку, можно принять объем ловушки равным 5—10% объема контура с очищаемым теплоносителем.
2. Диаметр и высота ловушки должны быть связаны соотношением hi/dn = Q. Отсюда могут быть определены диаметр и высота ловушки данного объема. Такое соотношение размеров ловушки справедливо при значениях отношения диаметра ловушки к подводящему трубопроводу бтр в диапазоне.
3. Падение температуры в ловушке должно быть организовано на ее конце, у фронта выкристаллизации примесей (см. рис. 3.3, а). Концентрация примеси в очищенном теплоносителе соответствует концентрации насыщения при температуре зоны выкристаллизации. Чтобы поддерживать температуру зоны выкристаллизации на достаточно низком уровне по мере накопления примесей у дна ловушки, зона охлаждения должна перемещаться вверх. Сигналом к перемещению должно служить существенное уменьшение скорости очистки. Для передвижения зоны охлаждения служат обычно поочередно включаемые водяные рубашки.
4. В трубопроводе, к которому подсоединяется ловушка, режим течения должен быть турбулентным. При малых расходах теплоносителя целесообразно устанавливать в трубопроводе перед ловушкой турбулизующие шайбы.
Температура места врезки ловушки в контуре не имеет принципиального значения, однако при врезке в зонах минимальных температур уменьшаются потери на охлаждение теплоносителя. Диффузионную ловушку можно использовать не только в циркуляционных контурах, но также в баках и в установках без циркуляции. При врезке диффузионной ловушки в горячий бак в ней также будут скапливаться примеси. Место врезки должно определяться из условий максимальной интенсивности естественной конвекции в зоне ловушки. Однако скорость очистки при врезке ловушки в горячий бак существенно меньше, так как доставка примесей в зону кристаллизации осуществляется только посредством медленных процессов молекулярной диффузии и естественной конвекции.
Диффузионные холодные ловушки имеют чрезвычайно простую конструкцию. Они просты в обслуживании, мало чувствительный колебаниям температуры и расхода теплоносителя в контуре, к повышению концентрации примеси в нем. Недостаток заключается в том, что для увеличения емкости ловушек необходимо перемещать зону охлаждения — кристаллизации вдоль ловушки. От этого недостатка свободны дисковые ловушки. Они представляют собой набор последовательно расположенных диффузионных ловушек, каждая из которых выполнена в виде круглого диска (см. рис. 3.3, б). Охлаждаемое дно диска, у которого кристаллизуются примеси, имеет большую поверхность Благодаря такой форме заполнения диска примесями всего на 1/3 радиуса означает заполнение 60% объема ловушки. К тому же дисковые перегородки являются теплопередающими ребрами, которые отводят тепло и способствуют кристаллизации примесей при заполнении примесями периферийных охлаждаемых участков.
Экспериментальные данные по ловушкам дискового типа показывают, что оптимальное соотношение между радиусом диска и расстоянием между дисками должны быть /g/rg = 0,1-г-0,2. Внутренний диаметр отверстий в дисках должен быть равен внутреннему диаметру подводящего трубопровода. Соотношение между диаметром отверстия диска и диаметром диска должно находиться в пределах 0,2—0,3. Толщина дискового ребра из теплопроводной малолегированной стали должна быть для ловушки емкостью -~10 л около 5 мм. Очищенный с помощью такой ловушки натрий содержал по массе (2-3)10~4% кислорода.
Выше рассмотрены наиболее эффективные и простые методы очистки жидких металлов. Выбор метода или их комбинации определяется условиями эксплуатации и требованиями к чистоте теплоносителя.
Контроль содержания примесей. В процессе подготовки и очистки жидкого металла и непосредственно перед заполнением тепловых труб необходим контроль содержания примесей. Это в первую очередь коррозионно-активные примеси, такие, как окислы и легкодиссоциирующие примеси, например примеси водорода, способные выделять неконденсирующиеся газы в процессе эксплуатации тепловой трубы. В щелочных металлах могут находиться в значительных количествах примеси других металлов. Так, в натрии может быть до 3% калия, в калии — 3% натрия. Такие примеси могут создавать зону неизотермичности в тепловой трубе.
По-видимому, непрерывные методы контроля чистоты жидкого металла нецелесообразны. И наиболее удобен анализ пробы металла в химической лаборатории на все вредные примеси химическим, химико-спектральным, дистилляционным и другими методами. Описание метода анализа проб имеется в работах [1, 2].
Отбор пробы и сохранение представительности пробы при ее транспортировке и анализе теплоносителя — сложная и ответственная задача.
Требование полной идентичности количественного и качественного состава примесей в отобранной пробе и в теплоносителе в свою очередь определяет ряд требований к устройствам и способам отбора проб.
1. Инертный газ, используемый в устройствах для отбора проб, должен быть чистым и не должен вносить дополнительных примесей в пробу.
2. В объеме отобранной пробы не должно происходить перераспределения примесей в процессе затвердевания (кристаллизации) жидкого металла, т. е. не должен происходить процесс так называемой зонной очистки металла. Для того чтобы избежать перераспределения примесей при затвердевании, отобранную пробу быстро замораживают. Хорошие результаты получаются при охлаждении пробы расположенной внутри заполненной инертным газом полости, стенки которой омываются холодной водой.
3. Все детали системы пробоотбора должны быть изотермичными, так как охлаждение пробной порции металла может привести к выпадению части примесей в виде осадка в трактах и узлах, ведущих к ампуле для пробы. В таком случае проба будет непредставительной, результат контроля — искаженным.
4. Материал ампулы, в которую отбирают пробу, не должен взаимодействовать с теплоносителем и примесями.
Перечисленные требования не являются исчерпывающими. В каждом конкретном случае эти требования должны дополняться или облегчаться с учетом конкретной обстановки.
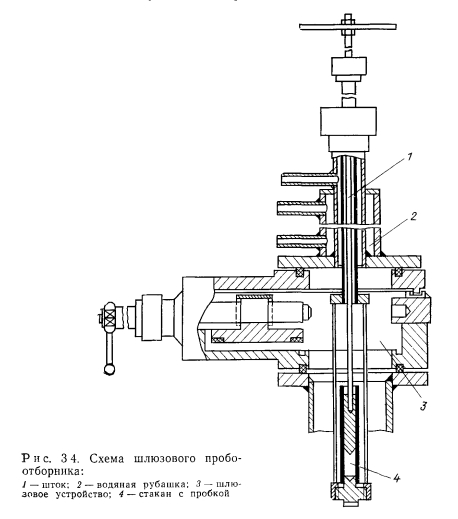
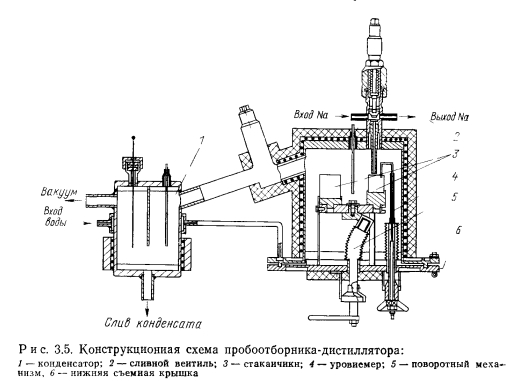
Весьма удобен для контроля содержания основных вредных примесей пробоотборник-дистиллятор (рис. 3.6). Он позволяет получать результаты анализа непосредственно на месте отбора проб, обладает универсальностью и обеспечивает достаточно высокую чувствительность и точность (табл. 3.1). Пробоотборник-дистиллятор широко применялся авторами для контроля содержания примесей кислорода и водорода в щелочных металлах, применяемых для тепловых труб. Принцип его действия прост. Проба жидкого металла сливается в стаканчик пробоотборника, установленный внутри отвакуумированного корпуса пробоотборника. Затем при анализе на содержание кислорода проба из стаканчика полностью выпаривается при определенной температуре (450° С для натрия). После окончания дистилляции стаканчик извлекается и оставшиеся на его дне окислы анализируемого щелочного металла титруются на воздухе в водном растворе для определения количества кислорода в пробе.

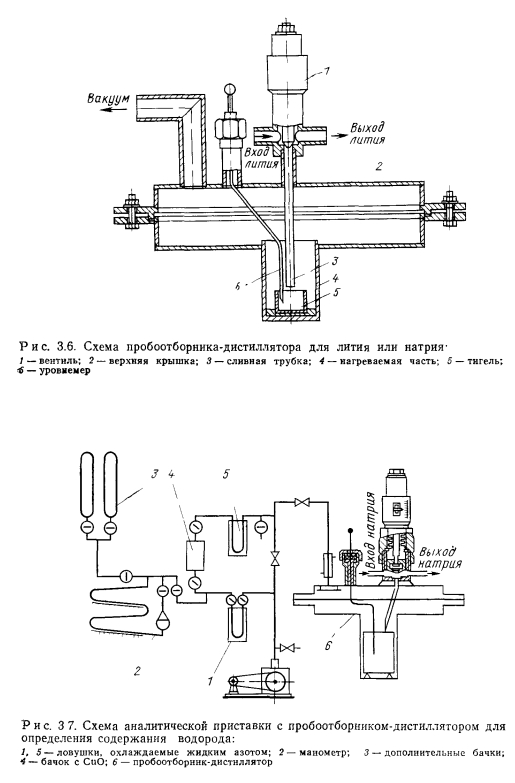
Дистилляционным методом кроме содержания кислорода можно определить содержание водорода, выделяющегося из пробы вследствие диссоциации водородсодержащих примесей (рис. 3.7). Выделяющийся в процессе дистилляции пробы водород собирается в колбе со специальными поглотителями (например, нагретая до 450°С и диспергированная окись меди СиО). Измеряя количество образовавшихся при восстановлении окиси меди водяных паров удалось достигнуть чувствительности определения водорода 10~40/о по массе при массе отбираемой пробы 75 г и погрешности не более 20%. Возможно определение выделяющихся при дистилляции водорода и других газов с помощью масс-спектрометров или газовых хроматографов. Пробоотборник- дистиллятор позволяет совмещать определение содержания водорода в процессе дистилляции с определением содержания кислорода в остатке после дистилляции.
С помощью пробоотборника-дистиллятора можно отбирать- пробы в ампулы с узким горлышком для передачи в химическую лабораторию для определения содержания металлических примесей. Для этой цели ампулы устанавливают вниз горлышком в стакан пробоотборника. Пробоотборник вакуумируется, стакан заполняется жидким металлом. Затем в полость пробоотборника подается инертный газ и жидкий металл из стакана передавливается в ранее отвакуумированные ампулы, а после замерзания металла пробоотборник вскрывают, ампулы извлекают. Горлышки: ампул пережимают для обеспечения герметизации.
